Sabtu, 30 Juli 2016
Stokiometri : Pereaksi Pembatas dan Pereaksi Berlebih
Dalam suatu reaksi kimia, apabila kita menggunakan
reagn atau pereaksi terkadang kita menggunakan pereaksi yang berlebih untuk
satu reagn dengan tujuan agar reagn yang lain habis bereaksi dan diperoleh
hasil yang maksimal sesuai keinginan. Sering terjadi satu reagen dibuat berlebih, sampai suatu reagen tertentu sudah
habis digunakan dalam reaksi sebelum reagen yang lainnya habis.
Pereaksi pembatas (limiting
reactant) = zat pereaksi yang habis bereaksi lebih dahulu, dan menjadi
penentu jumlah produk yang dihasilkan. Sedangkan Pereaksi berlebih (excess)
= pereaksi yang jumlahnya melebihi dari jumlah yang dibutuhkan.
Mari kita ambil contoh reaksi berikut
ini :
Sebanyak 2,8 gram gas Nitrogen
direaksikan dengan 1,2 gram gas Hidrogen. Manakah yang akan menjadi pereaksi
pembatas dan manakah yang akan menjadi pereaksi berlebih, serta berapa gram
produk Amonia yang akan dihasilkan ?
Untuk menjawab hal ini maka kita buat
persamaan reaksinya serta ketersedian dan kebutuhan masing-masing reagn atau
pereaksi.
Apabila kita lihat persamaan reaksi
setaranya terlihat bahwa 1 mol gas nitrogen akan bereaksi dengan 3 mol gas
hidrogen menghasilkan 2 mol gas amonia. Ini berarti perbandingan mol nitrogen :
hidrogen adalah 1:3. Perbandingan ini menunjukkan kebutuhan yang harus dipenuhi.
Selanjutnya Setelah kita konversi massa (gram) reagn
kedalam mol, maka reagen yang tersedia adalah 2,8 gram gas nitrogen (0,1 mol
nitrogen) dan 1,2 gram gas hidrogen (0.6 mol hidrogen). Jadi perbandingan mol
Nitrogen : hidrogen adalah 0,1: 0,6 atau dibulatkan menjadi 1:6
Dari sini kita bisa melihat bahwa dalam
reaksi itu 1 mol Nitrogen hanya membutuhkan 3 mol hidrogen, sementara yang
tersedia adalah 6 mol hidrogen. Sehingga dalam contoh reaksi diatas gas
hidrogen adalah pereaksi berlebih dan gas nitrogen adalah pereaksi pembatas.
Sehingga diakhir reaksi kita akan
menjumpai sisa hidrogen sebanyak 0,3 mol dan produk amonia yang dihasilkan
adalah 0,2 mol amonia.
Konsep Mol dan Stoikiometri
Istilah ''mol'' simbol
(n) merupakan istilah yang tidak asing dalam kimia. Apabila kita mengingat
ingat kembali pelajaran IPA SMP kita pasti pernah bertemu dengan tujuh besaran
pokok dengan satuan internasional. Nah disanalah kita bertemu dengan istilah ''mol''.
Jadi mol (n) adalah satuan untuk besaran pokok jumlah zat. Sementara Definisi
untuk 1 mol zat = 6,02 x 1023 partikel. Partikel dapat berupa atom,
molekul atau dalam bentuk ion.
Konsep mol sangat
berperan dalam stoikiometri kimia. Kata stoikiometri berasal dari bahasa Yunani
yaitu stoicheon yang artinya unsur dan metron yang
berarti mengukur. Seorang ahli Kimia Perancis, Jeremias Benjamin Richter
(1762-1807) adalah orang yang pertama kali meletakkan prinsip-prinsip dasar
stoikiometri. Menurutnya stoikiometri adalah ilmu tentang pengukuran
perbandingan kuantitatif atau pengukuran perbandingan antar unsur kimia yang
satu dengan yang lain.
Selanjutnya dalam
stoikiometri kita akan dikenalkan dengan beberapa istilah Volume Molar dan
Massa Molar. Mari kita ulas
satu persatu dari kedua istilah ini.
1. Volume Molar
Volume molar gas adalah
Volume satu mol gas pada keadan standar. Menurut Avogadro,
pada suhu dan tekanan yang sama gas-gas bervolume sama mengandung jumlah
molekul yang sama pula. Hal itu juga berarti bahwa pada suhu dan tekanan yang
sama gas-gas dengan jumlah molekul yang sama akan mempunyai volume yang sama.
Pada kondisi tekanan 1 atm (760 mmHg) dan temperatur 0o
C (273
K) disebut sebagai keadaan standar (Standard Temperature
and Pressure). banyaknya Volume 1
mol gas adalah 22,4 liter.
2. Massa Molar
Massa Molar adalah
Massa (gram ) suatu zat dari satu mol zat itu. Nilai untuk Massa Molar sama
dengan nilai Massa atom relatif (Ar) pada atom. Atau nilai Massa molekul
relatif (Mr) pada suatu molekul. Yang menjadi pembeda adalah ‘’satuan’’. Untuk massa
molar digunakan satuan (gram/mol) sementara untuk Ar atau Mr digunakan satuan
amu (atomic mass unit) dalam bahasa indonesia disebut sma (satuan massa atom)
yang bisa kita peroleh dalam tabel periodik unsur.
Para ahli kimia
menggunakan atom karbon Sebagai atom standar, yaitu atom karbon, C-12 dimana
satu mol C-12 terdiri dari 6,02 x 1023
atom dan memiliki massa 12 gram. Hal ini berarti massa molar atom C-12 adalah
12 gram/mol. Jadi nilai ini sama saja dengan nilai Ar C-12. Kemudian Jika kita
melihat tabel periodik kita mendapatkan Ar H=1 sma, N =14 sma, dan O =16 sma
Berarti massa molar gas H2 N2
dan O2 berturut turut adalah 2 gr/mol, 28 gram/mol dan 32 gram/mol
Jumat, 29 Juli 2016
Reaksi Reduksi dan Oksidasi
Disalin dari Makalah PPM-PPG 2004
Karya Pak Suwardi Kimia FMIPA UNY
Karya Pak Suwardi Kimia FMIPA UNY
Perubahan kimia yang terjadi bila elektron dipindahkan antara reaktan-reaktan
dikenal sebagai reaksi oksidasi-reduksi. Reaksi oksidasi adalah sumber utama
energi di bumi. Pembakaran bensin di dalam mesin mobil dan terbakarnya kayu
dalam suatu kebakaran adalah reaksi oksidasi. Demikian juga pembakaran makanan
dalam tubuh kita. Semua reaksi oksidasi dsertai reaksi reduksi. Reaksi
reduksi-oksidasi juga disebut reaksi
redoks.
Mula-mula makna oksidasi adalah kombinasi secara kimia suatu zat
dengan oksigen sedangkan reduksi adalah pelepasan/hilangnya oksigen. Sekarang
oksidasi ditinjau sebagai sebarang pergeseran elektron menjauhi dari sebuah
atom sedangkan reduksi adalah meliputi pergeseran elektron menuju suatu atom.
Suatu reaksi oksidasi selalu disertai oleh reaksi reduksi. Zat yang menyebabkan
oksidasi disebut zat pengoksidasi (oxidizing
agent atau oksidator). Zat yang
menyebabkan reduksi disebut zat pereduksi (reducing
agent atau reduktor).
Sebuah bilangan oksidasi dapat ditandakan pada sebuah unsur
dalam suatu zat sesuai dengan sehimpunan aturan. Bilangan oksidasi suatu unsur
dalam keadaan tak tergabung adalah nol. Bilangan oksidasi ion monoatomik
adalah sama dalam hal besar dan tanda seperti muatan ioniknya. Jumlah
bilangan oksidasi unsur dalam sebuah senyawa netral adalah nol. Akan
tetapi dalam ion poliatomik, jumlah bilangan oksidasi unsur sama dengan muatan
dari ion ini. Suatu kenaikkan bilangan oksidasi adalah oksidasi sedangkan
penurunan bilangan oksidasi adalah reduksi.
Proses
oksidasi-reduksi dapat ditinjau dari berbagai hal. Berikut ini akan disajikan
berbagai contoh untuk memperjelas hal ini.
1. Oksigen dalam reaksi redoks
Konsep lama :
Oksidasi : kombinasi suatu unsur dengan oksigen untuk menghasilkan oksida
·
Unsur dan senyawa bergabung dengan
oksigen dalam reaksi oksidasi
Unsur
:
4Fe + 3O2 à 2Fe2O3
C + O2
à CO2
Senyawa
:
CH4 + 2O2 à CO2 + 2H2O
Reduksi : Hilangnya oksigen dari senyawa
2Fe2O3
+ 3C à 4Fe +
3CO2
besi(III)
oksida karbon besi karbon dioksida
Istilah
reduksi (pengurangan) berkaitan dengan fakta bahwa bila logam oksida direduksi
menjadi logam, terdapat penurunan dalam hal volum logam oksida.
2. Perpindahan elektron dalam
reaksi redoks
Konsep baru :
·
Oksidasi : hilangnya elektron sebagian atau
seluruhnya atau terimanya oksigen.
·
Reduksi : terimanya elektron atau hilangnya
oksigen
Contoh
reaksi logam dengan bukan logam, elektron dipindahkan dari atom logam ke atom
bukan logam
Mg + S à
Mg2+ + S2-
Oksidasi
: Mg à
Mg2+ + 2e- (hilangnya elektron)
Reduksi
: S
+ 2e- à S2- (terimanya elektron)
Mg : reducing agent (donor
elektron)
S : oxidizing agent (akseptor elektron)
Perpindahan
seluruhnya (lengkap) elektron dapat terlihat mudah dalam reaksi ionik di atas.
Bagaimana tentang reaksi yang menghasilkan senyawa kovalen ? Tinjau reaksi
hidrogen dan oksigen,
2H2 + O2
à 2H2O
Definisis
lama oksidasi menyatakan bahwa hidrogen teroksidasi menjadi air bila ia bergabung dengan oksigen. Perpindahan
elektron dapat juga menjelaskan proses ini. Tinjaulah apa yang terjadi
terhadap elektron ikatan dalam reaktan dan produk. Elektron ikatan dalam
molekul hidrogen digunakan bersama secara sama antara hidrogen-hidrogen. Namun
demikian, dalam air, elektron ikatan tidak digunakan secara sama antara
hidrogen dan oksigen. Akibatnya adalah pergeseran elektron ikatan menjauhi
hidrogen.
Hidrogen
teroksidasi (elektron bergeser menjauhi H) sedangkan oksigen tereduksi
(elektron bergeser menuju ke O)
Secara
ringkas proses yang menyebabkan oksidasi dan reduksi disajikan dalam tabel 1.
|
NO
|
OKSIDASI
|
REDUKSI
|
|
1
|
Hilangnya seluruh
(lengkap) elektron [reaksi ionik]
|
Terimanya
elektron secara lengkap [reaksi ionik]
|
|
2
|
Pergeseran
elektron menjauhi suatu atom dalam ikatan kovalen
|
Pergeseran
elektron menuju suatu atom dalam ikatan kovalen
|
|
3
|
Terimanya oksigen
|
Hilangnya oksigen
|
|
4
|
Hilangnya
hidrogen untuk senyawa kovalen
|
Terimanya
hidrogen untuk senyawa kovalen
|
|
5
|
Kenaikkan
bilangan oksidasi
|
Penurunan
bilangan oksidasi
|
3. Manandai bilangan oksidasi
Bilangan
oksidasi adalah konsep tatabuku (bookkeeping) yang diberikan oleh ahli kimia. Bilangan
oksidasi adalah suatu bilangan positif atau negatif yang ditandakan pada
suatu atom sesuai dengan sehimpunan aturan.
Aturan penandaan bilangan
oksidasi :
a.
Bilangan oksidasi ion monoatomik
sama dalam hal besar dan tanda dengan muatan ioniknya. Contoh : biloks
ion bromida, Br1-, adalah -1; biloks ion Fe3+ adalah +3.
b.
Biloks hidrogen dalam suatu
senyawa selalu +1 kecuali dalam logam hidrida, contoh dalam NaH,
biloks H adalah -1
c.
Biloks oksigen dalam suatu senyawa
adalah selalu -2 kecuali dalam peroksida, contoh dalam H2O2
biloks O adalah -1
d.
Biloks unsur tak tergabung dengan
unsur lain adalah nol. Contoh, biloks atom K (kalium) dalam logam
kalium, K; dan atom nitrogen dalam gas N2, adalah nol
e.
Untuk senyawa netral, jumlah
biloks dari atom-atom dalam senyawa harus sama dengan nol
f.
Untuk ion poliatomik, jumlah
biloks atom harus sama dengan muatan ionik dari ion
Persamaan Reaksi Kimia
Persamaan Reaksi Kimia
Persamaan yang menggambarkan terjadinya suatu reaksi kimia.
Misal : dua molekul gas hidrogen direaksikan dengan satu
molekul gas oksigen, menjadi dua molekul air (liquid). Maka reaksi kimia ini
apabila ditulis persamaan reaksi kimianya adalah sebagai berikut :
2H2(g)
+ O2(g) --> 2H2O (l)
Reaksi kimia selalu melibatkan zat pereaksi (reaktan) dan
menghasilkan zat hasil reaksi (produk). Dalam persamaan reaksi kimia reaktan
ditulis disebelah kiri tanda panah, dan produk ditulis disebelah kanan tanda
panah. Sementara angka didepan senyawa disebut koefisien reaksi. Jadi Pada contoh
reaksi diatas, hidrogen dan oksigen disebut reaktan dan air disebut produk.
PERSAMAAN REAKSI KIMIA SETARA
Persamaan Reaksi Kimia Setara adalah ketika jumlah atom dan
muatan total diruas kiri dan kanan jumlahnya sama. (memenuhi hukum kekekalan
masa)
Contoh :
Reaksi belum setara :
Reaksi belum setara :
Reaksi Sudah setara :
Tatanama Senyawa Anorganik Sederhana
I. Senyawa Ionik Biner (Logam IA, IIA, IIIA dengan Nonlogam)
2. Senyawa Kovalen Biner (Nonlogam-Nonlogam)
3. Senyawa Poliatom (Terner)
4. Logam Transisi / Multivalensi
5. Senyawa yang mengandung Hidrogen (H) dan Hidroksi (OH)
6. Senyawa yang mengandung air terhidrat
2. Senyawa Kovalen Biner (Nonlogam-Nonlogam)
3. Senyawa Poliatom (Terner)
4. Logam Transisi / Multivalensi
5. Senyawa yang mengandung Hidrogen (H) dan Hidroksi (OH)
6. Senyawa yang mengandung air terhidrat
Larutan Elektrolit dan Nonelekrolit
Beberapa zat jika dilarutkan
dalam air atau zat itu berupa larutan, memiliki kemampuan menghantarkan arus
listrik yang berbeda. Larutan yang mampu menghantarkan arus listrik disebut
sebagai larutan elektrolit. Jumlah arus listrik yang dapat dihantarkan
bergantung pada jumlah ion yang ada didalam larutan. Beberapa zat dapat
terionisasi sempurna (100%) ketika dilarutkan dalam air, maka larutan tersebut
tergolong elektrolit kuat.
Contoh :
Adapula zat yang terionisasi kurang sempurna (<
100%) dengan kata lain sebagian zat dalam larutan terionisasi dan sebagian lain
tidak mengion. larutan semacam ini tergolong elektrolit lemah. Adapula zat yang
ketika dilarutkan dalam air tidak menghasilkan ion. Dengan tidak adanya ion
dalam larutan, maka larutan tak mampu menghantarkan arus listrik. larutan semacam
ini disebut sebagai larutan nonelektrolit.
Contoh :
dilaboratorium uji, serangkaian alat dapat disusun dengan menggunakan Indikator nyala lampu. mari perhatikan gambar rangkaian alat berikut :
Pada gambar diatas terlihat
serangkaian percobaan untuk mengukur daya hantar arus listrik larutan. Indikator
yang digunakan dalam percobaan diatas adalah indikator nyala lampu dan jumlah
gelembung gas yang dihasilkan dalam larutan. Bila kita urutkan dari sebelah
kiri, gambar pertama menunjukkan tidak ada ion dalam larutan yang ada adalah
molekul molekul netral, ini menunjukkan larutan tergolong nonelektrolit
terlihat dengan tidak adanya nyala lampu dan gelembung gas. Gambar ditengah
terlihat ada sedikit ion, dan adapula molekul netral ini menunjukkan bahwa
sebagian zat mengion dalam larutan tersebut, sementara sebagian lagi tidak
mengion. Indikator lampu menyala dengan redup dan jumlah gelembung gas yang
dihasilkan sedikit. Maka larutan kedua ini tergolong elektrolit lemah. Gambar terakhir
menunjukkan bahwa larutan ini adalah larutan elektrolit kuat, kita melihat
bahwa disana terdapat banyak ion dan kita tidak menjumpai molekul netral. Indikator
lampu pun terlihat menyala dengan terang dan banyak dihasilkan gelembung gas
dalam larutannya.
berikut ini adalah contoh beberapa zat yang diklasifikasikan sesuai dengan daya hantar arus listrik larutannya :
STRUKTUR MOLEKUL BERDASARKAN TEORI VSEPR
Ada beberapa teori yang dapat
meramalkan bentuk struktur suatu molekul yaitu : teori VSEPR yang dikemukakan
oleh Lewis dan teori ikatan valensi orbital hibrid mekanika kuantum. Pada
kesempatan ini penulis akan mencoba untuk menuliskan dari sisi teori VSEPR.
Teori VSEPR merupakan kepanjangan
dari Valence Shell Electron Pair Repulsion. Secara arti harfiahnya
adalah Teori Tolakan Pasangan Elektron Kulit Valensi. Teori ini adalah teori
yang dapat meramalkan bentuk molekul berdasarkan gaya tolak menolak elektron
valensi atom pusat. Prinsip utama teori ini adalah bahwa bentuk molekul itu
ditentukan oleh ada atau tidaknya tolakan elektron bonding dan non bonding elektron Dalam bahasa kita, teori ini dikenal dengan
istilah teori Domain Elektron. Untuk memahami teori ini anda sudah memahami
ikatan kimia. Karena dalam bahasan topik ini akan digunakan istilah bonding (PEI)
dan non bonding (PEB).
Elektron merupakan partikel
bermuatan negatif (-) sehingga sesama elektron akan saling tolak menolak satu
sama lain, sehingga dalam suatu molekul awan elektron akan menyusun diri untuk
meminimalkan gaya tolak menolak tersebut. Berikut ini disajikan bentuk-bentuk
dasar suatu molekul, yang dimaksud bentuk dasar yaitu bentuk yang tidak
mengalami distorsi dari non bonding elektron (nol).
Sekarang, mari kita ambil satu
contoh molekul dari data diatas, yaitu molekul methana CH4 , molekul
ini memiliki 4 domain elektron yang terdiri dari 4 buah elektron bonding dan
tak memiliki elektron non bonding (nol). Sehingga awan elektron disekitar atom
pusat karbon tersebar pada empat ikatan dengan atom hidrogen. Struktur lewis
merupakan struktur 2-D, sehingga sudut ikatan yang memungkinkan untuk struktur
2-D adalah 900 .
Namun bagaimanapun, bentuk
molekul yang sesungguhnya digambarkan dalam bentuk 3-D (model ball and stic) sudut ikatan yang dibuntuk antara atom Carbon
dan Hydrogen adalah sebesar 109,50
Nah, jadi kesimpulannya bentuk
geometri molekul untuk molekul CH4 menurut teori VSEPR adalah
tetrahedron.
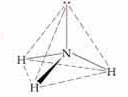
Sekarang mari kita lihat bentuk
geometri molekul lain yaitu molekul amonia NH3 , dimana jumlah
Domain molekul NH3 ini sama dengan jumlah domain pada CH4 yaitu sebanyak 4 domain. Namun
perbedaannya adalah Domain elektron NH3 terdiri dari 3 buah elektron
bonding dan 1 buah elektron non bonding. Mari kita lihat struktur lewis atau
struktur 2-D dari NH3
Dari gambar diatas terlihat
adanya satu buah nonbonding elektron, Keberadaan 1 buah elektron non bonding
pada NH3 ini akan menyebabkan distorsi pada molekul NH3
Namun bagaimanapun, ketika kita
melihat bentuk molekul, kita tidak akan bisa melihat non bonding elektron,
karena ia tidak terpasang dengan atom. Sehingga gambar diatas jika dilihat dalam
bentuk molekul adalah sebagai berikut :
Sudut ikatan yang dibentuk oleh
atom nitrogen dan hidrogen pada amonia adalah sebesar 107,50 . Jika
kita menggambarkan bentuk geometri molekul NH3 maka gambarnya adalah
sebagai berikut :
Sehingga kesimpulannya bentuk
geometri molekul untuk molekul NH3 menurut teori VSEPR adalah
trigonal piramida.
Selanjutnya mari kita lihat
bentuk geometri molekul lain yaitu molekul air H2O ,
dimana jumlah Domain molekul H2O ini sama dengan jumlah domain pada
CH4 dan NH3
sebanyak 4 domain. Namun perbedaannya adalah Domain elektron H2O
terdiri dari 2 buah elektron bonding dan 2 buah elektron non bonding. Kita
akan lihat bagaimana perubahan bentuk geometrinya. Mari kita lihat struktur
lewis atau struktur 2-D dari H2O
Dari gambar diatas terlihat
adanya dua buah nonbonding elektron, Keberadaan 2 buah elektron non bonding
pada H2O ini akan menyebabkan distorsi pada molekul H2O
Sudut ikatan yang dibentuk oleh
atom oksigen dan hidrogen pada molekul air adalah sebesar 104,50 . Jika
kita menggambarkan bentuk geometri molekul H2O maka gambarnya adalah
sebagai berikut :
Sehingga kesimpulannya bentuk
geometri molekul untuk molekul H2O menurut teori VSEPR adalah bentuk bent
(bengkok) .
Kamis, 28 Juli 2016
Ikatan Kimia
Mengapa atom atom memiliki kecenderungan untuk berikatan? Karena setiap atom ingin memiliki elektron terluar yang stabil seperti gas mulia. Hal ini disebabkan karena Unsur – unsur golongan gas mulia ( golongan VIII A) yaitu He (Helium), Ne (Neon), Ar (Argon), Kr (Kripton), Xe (Xenon), dan Rn (Radon) bersifat stabil sehingga disebut mulia. Karena sifat stabilnya, unsur-unsur Gas Mulia ini dapat berdiri sendiri, ditemukan di alam dalam bentuk monoatomik dan jarang sekali ditemukan dalam bentuk senyawa. Unsur unsur gas mulia hampir tidak membentuk ikatan dengan atom lain dan karena tidak reaktifnya maka sering disebut juga sebagai gas inert. Pertanyaannya adalah mengapa bisa terjadi hal demikian pada unsur golongan gas mulia?
Pada Tahun 1916 G.N. Lewis dan W. Kossel menjelaskan hubungan kestabilan gas mulia dengan konfigurasi elektron. unsur-unsur gas mulia mempunyai 8 elektron valensi (setiap orbital elektronnya terisi penuh/berpasangan) sehingga gas mulia bersifat stabil. Kecuali He; mempunyai 2 elektron valensi.
2He4 : 2
10Ne20 : 2 8
18Ar40 : 2 8 8
36Kr84 : 2 8 18 8
54Xe131 : 2 8 18 18 8
86Rn(222): 2 8 18 32 18 8
Unsur – unsur lain cenderung mengikuti gas mulia untuk mencapai kestabilan. Atom-atom lain agar stabil berusaha memiliki konfigurasi elektron seperti gas mulia. Kecenderungan ini bisa terjadi dengan membentuk ikatan kimia antar atom yang satu dengan atom lainnya. Apabila suatu atom mencapai kestabilan dengan 2 elektron valensi menyerupai unsur He maka disebut sebagai kaidah duplet. Sedangkan suatu atom yang mencapai kestabilan dengan 8 elektron valensi maka disebut sebagai kaidah Oktet.
Ikatan Ion
Ikatan ini terjadi ketika ada perbedaan tendensi yang sangat besar dari atom untuk melepas atau menangkap elektron. Atom-atom yang melepas elektron menjadi ion positif (kation) sedang atom-atom yang menerima elektron menjadi ion negatif (anion). Perbedaan yang sangat mencolok terjadi antara logam alkali yang reaktif (golongan IA) dan non logam, golongan halogen (golongan VII A). Atom logam dengan harga ionisasi yang rendah mudah melepaskan elektron valensinya, sementara atom non logam dengan afinitas elektron yang besar (elektronegatif) dengan mudah menangkap elektron
Keadaan ini menyebabkan terjadinya transfer elektron antara logam dan non logam membentuk ion menyerupai konfigurasi gas mulia.
Misalnya, pada Ikatan NaCl, atom Na yang tidak stabil melepaskan satu elektron valensinya menjadi ion Na+ dengan menyerupai konfigurasi elektron seperti atom neon (10Ne).
11 Na : 2 8 1
11 Na+ : 2 8
Sementara atom Cl menerima tambahan satu elektron, sehingga menjadi ion Cl- dengan konfigurasi elektron seperti konfigurasi elektron Argon (18Ar).
17 Cl : 2 8 7
17 Cl- : 2 8 8
Ketika atom natrium melepaskan sebuah elektron valensinya sehingga terjadi ion natrium, Na+ dan elektron ini diterima oleh atom klor sehingga terjadi ion klorida, Cl-. ion klorida dan ion natrium saling tarik menarik dengan gaya elektrostatis sehingga terjadi ikatan ion yang menghasilkan senyawa ionik NaCl.
Sifat-sifat fisika senyawa ionik pada umumnya:
1. pada suhu kamar berwujud padat
2. struktur kristalnya keras tapi rapuh
3. mempunyai titik didih dan titik leleh tinggi
4. larut dalam pelarut air tetapi tidak larut dalam pelarut organik
5. tidak menghantarkan listrik pada fase padat, tetapi pada fase cair (lelehan) dan larutannya menghantarkan listrik
Ikatan Kovalen
Ikatan kovalen adalah ikatan yang terbentuk karena pemakaian bersama dua elektron oleh dua atom. Pertanyaannya adalah kenapa dua atom saling berbagi elektron ? Pasalnya tidak seperti ikatan ionik, dalam ikatan kovalen hanya terjadi perbedaan kecil pada tendensi untuk melepas atau menangkap elektron sehingga terjadi sharing elektron. ikatan ini umum terjadi antar atom non logam. Tiap-tiap atom non logam mempertahakan elektron masing masing dan mencoba menarik elektron atom lain. Gaya tarik masing-masing atom terhadap elektron valensi lawannya membuat kedua atom berikatan. Ikatan kovalen terjadi karena pemakaian bersama pasangan elektron (Sharing electron pair) oleh atom-atom yang berikatan. Pasangan elektron yang dipakai bersama disebut pasangan elektron ikatan (PEI) dan pasangan elektron valensi yang tidak terlibat dalam pembentukan ikatan kovalen disebut pasangan elektron bebas (PEB). Pasangan elektron sharing (dipakai bersama) dianggap elektron yang terlokalisasi diantara kedua atom sehingga menjadi milik bersama.
Atom-atom yang sama atau hampir sama keelektronegatifannya cenderung membentuk ikatan kovalen dengan menggunakan pasangan elektron bersama. Hampir semua senyawa kovalen terbentuk dari atom-atom non-logam seperti H2, Cl2, O2, NH3, CH4, CO2 dan lain sebagainya. Dua atau lebih atom nonlogam saling menyumbangkan elektron sehingga tersedia satu atau lebih pasangan elektron yang dijadikan milik bersama. Sebagai contoh Atom hidrogen memiliki sebuah elektron pada kulit pertamanya, agar konfigurasi elektronnya penuh seperti gas mulia helium (2He) maka hidrogen memerlukan satu elektron lagi. Gas hidrogen yang merupakan molekul H2 terdiri dari dua atom hidrogen yang saling menyumbangkan elektronnya sehingga masing-masing atom hidrogen memiliki konfigurasi elektron yang stabil.
Contoh lain adalah pada ikatan molekul H2O. Atom oksigen yang mempunyai 6 elektron valensi membutuhkan 2 elektron lagi agar seperti gas mulia. Kedua elektron itu diperoleh dari dua atom hidrogen. Jadi atom oksigen dapat membentuk dua ikatan kovalen dalam molekul H2O.
8O : 2 6
1H : 1
Ikatan Kovalen itu bermacam-macam jenisnya, apabila dilihat dari pasangan elektron ikatannya, ikatan kovalen dibagi menjadi ikatan kovalen tunggal, Ikatan kovalen rangkap (double bond ) dan ikatan rangkap tiga (triple bond). Pada ikatan kovalen tunggal mengandung dua elektron (contoh pada molekul H2), ikatan kovalen rangkap dua mengandung empat elektron seperti Pada molekul oksigen, O2 terdapat dua buah ikatan (double bond) Kedua atom oksigen masing masing memiliki 8 elektron valensi. Sedangkan dalam ikatan rangkap tiga terdapat enam elektron. Contohnya seperti pada molekul nitrogen, N2 setiap atomnya menyumbangkan 3 elektron untuk digunakan bersama sama sehingga setiap atom N memiliki elektron valensi 8.
Sementara apabila ditinjau dari kepolaran ikatan, maka ikatan kovalen dibedakan menjadi ikatan kovalen polar dan Non Polar.
Ikatan kovalen polar adalah ikatan kovalen dengan pasangan elektron ikatannya cenderung tertarik ke salah satu atom yang berikatan.Kepolaran suatu ikatan kovalen ditentukan oleh keelektronegatifan suatu unsur. Senyawa kovalen polar biasanya terjadi antara atom-atom unsur yang beda keelektronegatifannya besar dan mempunyai bentuk molekul yang tidak simetris, serta memiliki harga momen dipol yang lebih besar dari nol. Harga momen dipol merupakan hasil kali beda keelektronegatifan dengan jarak ikatan.
Contoh, pada molekul hydrogen fluorida HF. Atom H cenderung tertarik kearah atom F karena atom F lebih elektronegatif. Perbandingan kelektronegatifan H:F adalah 2.1 : 4.0 sehingga menyebabkan bentuk molekul menjadi tidak simetris atau terjadi polarisasi (membentuk kutub positif dan negatif).
Sementara pada Ikatan kovalen nonpolar yaitu ikatan kovalen yang pasangan elektron ikatannya tertarik sama kuat ke arah atom-atom yang berikatan. Senyawa kovalen nonpolar terbentuk antara atom-atom unsur yang mempunyai beda keelektronegatifan nol atau mempunyai momen dipol = 0 (nol) atau mempunyai bentuk molekul simetri. Contohnya seperti pada molekul H2.
Tidak semua ikatan kovalen yang terjadi, elektron-elektronnya diperoleh dari sumbangan atom-atom yang membentuk ikatan. Beberapa molekul ada yang pasangan elektronnya berasal dari salah satu atom saja, sedang atom lainnya menggunakan pasangan elektron
itu untuk berikatan. Hal ini terjadi seperti pada Molekul NH3 yang mempunyai satu pasang elektron yang belum digunakan bersama, sedang ion H+ dapat menerima satu pasang elektron untuk menjadi lebih stabil karena mempunyai konfigurasi elektron helium. Oleh karena itu pasangan elektron tersebut dapat digunakan bersama oleh molekul NH3 dan ion H+ sehingga terbentuk ion amonium, NH4+. Ikatan antara NH3 dengan ion H+ ini juga merupakan ikatan kovalen yang diberi nama ikatan kovalen koordinasi.
Contoh lain terjadi pada molekul SO3 atom Sulfur, 16S : 2 8 6 memiliki 6 elektron Valensi, 2 buah elektron digunakan untuk berikatan rangkap dengan 1 atom O dan 2 pasang elektron lagi disediakan untuk 2 buah atom O yang lain, karena atom O memiliki elektron valensi 6 dan memutuhkan 2 elektron, sehingga atom O dapat menerima sepasang elektron dari atom S. Dengan demikian terdapat 2 buah ikatan kovalen koordinasi dan keempat atom memiliki elektron valensi 8 yang stabil.
Ikatan Logam
Drude dan Lorentz mengemukakan model, bahwa logam sebagai suatu kristal terdiri dari ion-ion positif logam dalam bentuk bola-bola keras dan sejumlah elektron yang bergerak bebas dalam ruang antara. Elektron-elektron valensi logam tidak terikat erat (karena energi ionisasinya rendah), sehingga elektron relatif lebih bebas bergerak. Hal ini dapat dimengerti mengapa logam bersifat sebagai penghantar panas dan listrik yang baik, dan juga mengkilat. Suatu model logam dengan elektron-elektron membentuk suatu “lautan” muatan negatif dapat dilihat seperti gambar berikut :
Model lautan elektron ini sesuai dengan sifat-sifat logam, seperti: dapat ditempa menjadi lempengan tipis, ulet karena dapat direntang menjadi kawat, memiliki titik leleh dan kerapatan yang tinggi. Logam dapat dimampatkan dan direntangkan tanpa patah karena atom-atom dalam struktur kristal harus berkedudukan sedemikian rupa sehingga atom-atom yang bergeser akan tetap pada kedudukan yang sama. Hal ini disebabkan mobilitas lautan elektron di antara ion-ion positif meru-pakan penyangga.
Sebagai Contoh terjadinya ikatan logam besi Fe, Pada Tempat kedudukan elektron valensi dari suatu atom besi (Fe) dapat saling tumpang tindih dengan tempat kedudukan elektron valensi dari atom-atom Fe yang lain. Tumpang tindih antarelektron valensi ini memungkinkan elektron valensi dari setiap atom Fe bergerak bebas dalam ruang di antara ion-ion Fe+ membentuk lautan elektron. Karena muatannya berlawanan (Fe2+ dan 2 e–), maka terjadi gaya tarik-menarik antara ion-ion Fe+ dan elektron-elektron bebas ini. Akibatnya terbentuk ikatan ikatan logam Fe.
Langganan:
Postingan (Atom)












































.png)
.png)
.png)
.png)
.png)
.png)


.png)
.png)
.png)