Teori VSEPR merupakan kepanjangan
dari Valence Shell Electron Pair Repulsion. Secara arti harfiahnya
adalah Teori Tolakan Pasangan Elektron Kulit Valensi. Teori ini adalah teori
yang dapat meramalkan bentuk molekul berdasarkan gaya tolak menolak elektron
valensi atom pusat. Prinsip utama teori ini adalah bahwa bentuk molekul itu
ditentukan oleh ada atau tidaknya tolakan elektron bonding dan non bonding elektron Dalam bahasa kita, teori ini dikenal dengan
istilah teori Domain Elektron. Untuk memahami teori ini anda sudah memahami
ikatan kimia. Karena dalam bahasan topik ini akan digunakan istilah bonding (PEI)
dan non bonding (PEB).
Elektron merupakan partikel
bermuatan negatif (-) sehingga sesama elektron akan saling tolak menolak satu
sama lain, sehingga dalam suatu molekul awan elektron akan menyusun diri untuk
meminimalkan gaya tolak menolak tersebut. Berikut ini disajikan bentuk-bentuk
dasar suatu molekul, yang dimaksud bentuk dasar yaitu bentuk yang tidak
mengalami distorsi dari non bonding elektron (nol).
Sekarang, mari kita ambil satu
contoh molekul dari data diatas, yaitu molekul methana CH4 , molekul
ini memiliki 4 domain elektron yang terdiri dari 4 buah elektron bonding dan
tak memiliki elektron non bonding (nol). Sehingga awan elektron disekitar atom
pusat karbon tersebar pada empat ikatan dengan atom hidrogen. Struktur lewis
merupakan struktur 2-D, sehingga sudut ikatan yang memungkinkan untuk struktur
2-D adalah 900 .
Namun bagaimanapun, bentuk
molekul yang sesungguhnya digambarkan dalam bentuk 3-D (model ball and stic) sudut ikatan yang dibuntuk antara atom Carbon
dan Hydrogen adalah sebesar 109,50
Nah, jadi kesimpulannya bentuk
geometri molekul untuk molekul CH4 menurut teori VSEPR adalah
tetrahedron.
Sekarang mari kita lihat bentuk
geometri molekul lain yaitu molekul amonia NH3 , dimana jumlah
Domain molekul NH3 ini sama dengan jumlah domain pada CH4 yaitu sebanyak 4 domain. Namun
perbedaannya adalah Domain elektron NH3 terdiri dari 3 buah elektron
bonding dan 1 buah elektron non bonding. Mari kita lihat struktur lewis atau
struktur 2-D dari NH3
Dari gambar diatas terlihat
adanya satu buah nonbonding elektron, Keberadaan 1 buah elektron non bonding
pada NH3 ini akan menyebabkan distorsi pada molekul NH3
Namun bagaimanapun, ketika kita
melihat bentuk molekul, kita tidak akan bisa melihat non bonding elektron,
karena ia tidak terpasang dengan atom. Sehingga gambar diatas jika dilihat dalam
bentuk molekul adalah sebagai berikut :
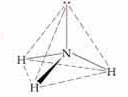
Sudut ikatan yang dibentuk oleh
atom nitrogen dan hidrogen pada amonia adalah sebesar 107,50 . Jika
kita menggambarkan bentuk geometri molekul NH3 maka gambarnya adalah
sebagai berikut :
Sehingga kesimpulannya bentuk
geometri molekul untuk molekul NH3 menurut teori VSEPR adalah
trigonal piramida.
Selanjutnya mari kita lihat
bentuk geometri molekul lain yaitu molekul air H2O ,
dimana jumlah Domain molekul H2O ini sama dengan jumlah domain pada
CH4 dan NH3
sebanyak 4 domain. Namun perbedaannya adalah Domain elektron H2O
terdiri dari 2 buah elektron bonding dan 2 buah elektron non bonding. Kita
akan lihat bagaimana perubahan bentuk geometrinya. Mari kita lihat struktur
lewis atau struktur 2-D dari H2O
Dari gambar diatas terlihat
adanya dua buah nonbonding elektron, Keberadaan 2 buah elektron non bonding
pada H2O ini akan menyebabkan distorsi pada molekul H2O
Sudut ikatan yang dibentuk oleh
atom oksigen dan hidrogen pada molekul air adalah sebesar 104,50 . Jika
kita menggambarkan bentuk geometri molekul H2O maka gambarnya adalah
sebagai berikut :
Sehingga kesimpulannya bentuk
geometri molekul untuk molekul H2O menurut teori VSEPR adalah bentuk bent
(bengkok) .










Tidak ada komentar:
Posting Komentar